人畜共患病(Zoonoses)指可自然地在人类与脊椎动物间传播的疾病,占新发传染病的75%以上。蝙蝠被认为是包括SARS、COVID-19等冠状病毒,以及亨尼帕病毒等多种人畜共患病原的天然宿主。然而,由于缺乏体外生理相关的实验模型,目前绝大多数通过宏基因组学发现的蝙蝠病毒仍未能被成功分离与培养,极大限制了对其致病性、传播路径及跨种传播风险的系统研究。
2025年5月15日,韩国大田基础科学研究所联合成均馆大学等团队在顶刊Science发表了题为“Diverse bat organoids provide pathophysiological models for zoonotic viruses”的论文,首次建立了横跨五种蝙蝠物种与四种器官类型的类器官资源库,不仅填补了当前蝙蝠-病毒互作模型的空白,更成功使用该类器官库分离了两种新型蝙蝠源病毒。抗病毒药物疗效测试中,该类器官库表现出比传统细胞系(如Vero E6细胞)更高的敏感性和特异性。至此,本研究为传染病构筑了全新的病毒溯源与药物筛选的实验平台。

01 类器官库的构建
研究团队从东亚地区获得的五种蝙蝠(包括大蹄蝠、中华菊头蝠、东亚家蝠、山蝠与阿拉善伏翼蝠)中分离组织样本,成功构建了呼吸道(气管、肺泡)、肾脏、小肠等四类类器官模型。
其中,气管与肺泡类器官培养时添加了R-spondin1、Noggin、FGF10、FGF7及A83-01(TGF-β抑制剂)等因子,肾脏类器官则在此基础上补充了CHIR-99021与EGF以维持肾前体分化能力。小肠类器官培养基中则添加了EGF, Noggin, R-spondin1、Wnt信号激动剂等。
多重免疫组化和scRNA-seq确认,获得的类器官系统高度还原了原代组织结构与细胞多样性。如在气管类器官中,研究人员检测到了丰富的纤毛细胞、基底干细胞和黏液细胞,而在肺部类器官中,支气管和肺泡上皮细胞的复杂结构也得到了很好的模拟。
四种类器官可在体外稳定培养超过6个月,并通过冷冻复苏维持表型不变,至此研究人员已成功建立4类可模拟蝙蝠器官生理特征的体外平台。
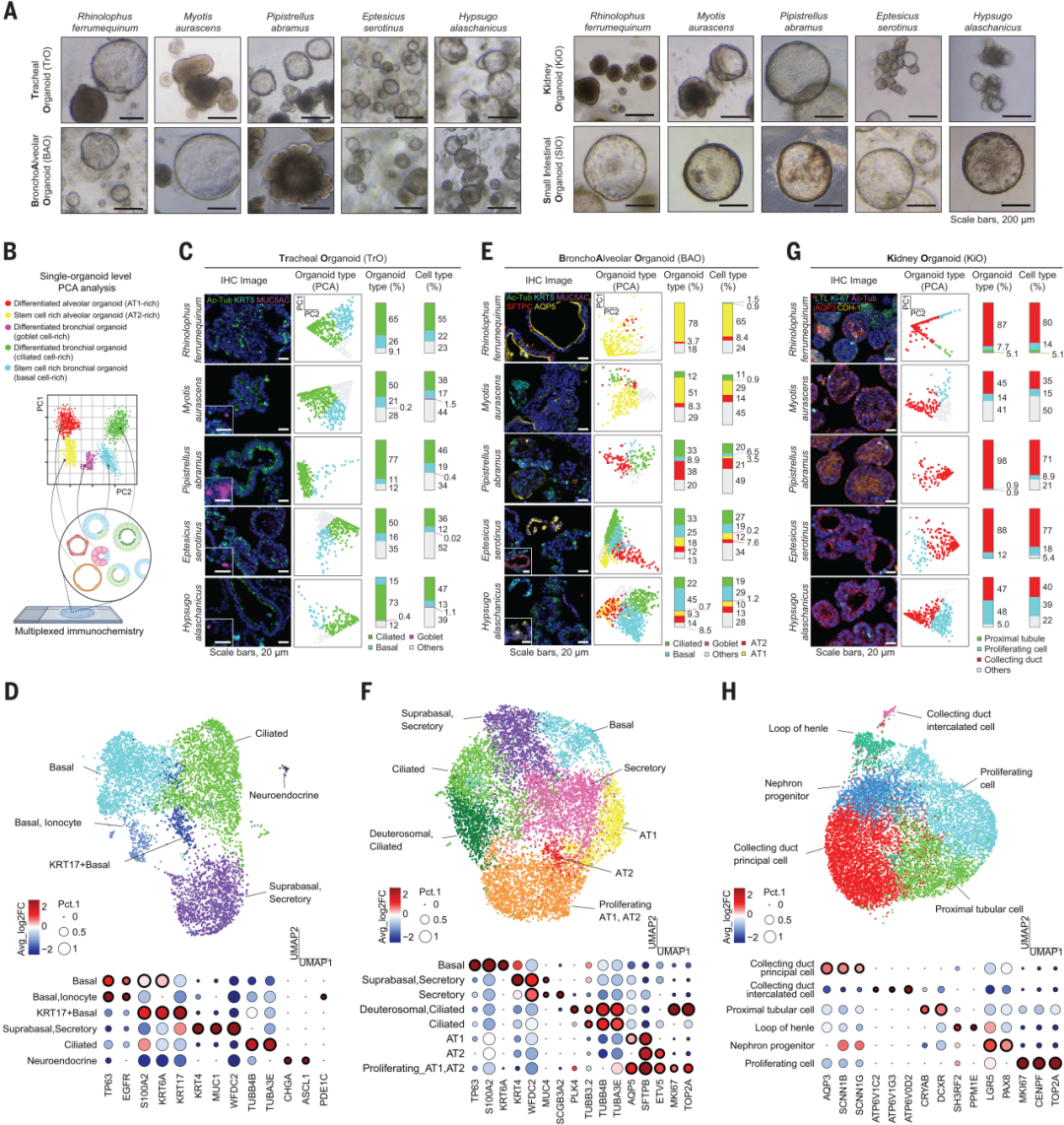
图1:来自5种蝙蝠的4种类器官的建立
02 多重病毒感染模型
为验证该平台在病毒学研究中的适用性,研究团队选择了多种代表性病毒株构建感染模型。
结果显示,SARS-CoV-2在除中华菊头蝠小肠类器官外的所有小肠或呼吸道类器官中无法有效复制,表明SARS-CoV-2对中华菊头蝠具有物种特异性。
相比之下,中东呼吸综合征冠状病毒(MERS-CoV)在三种蝙蝠的气管与肺泡类器官中均表现出高效复制,且病毒与受体DPP4的相互作用在蝙蝠和人类中保守。该发现支持MERS-CoV存在跨蝙蝠物种的宿主适应性,且可能为人类感染的自然中间宿主提供了更合理的解释路径。
禽源与人源流感病毒方面,H1N1与H9N2在多数类器官中均具感染性,但H5N1感染能力更强,且更具致病潜力。
值得注意的是,RNA-seq分析结果显示,MERS-CoV及IAV(人H1N1 CA04)感染均能显著诱导干扰素刺激基因ISGs的表达,表达水平与病毒感染的强度密切相关,且不同病毒诱导的ISGs存在差异。
以上结果表明,蝙蝠类器官能够有效地模拟病毒感染引起的免疫反应,为研究蝙蝠在病毒感染中的免疫机制提供了重要工具。
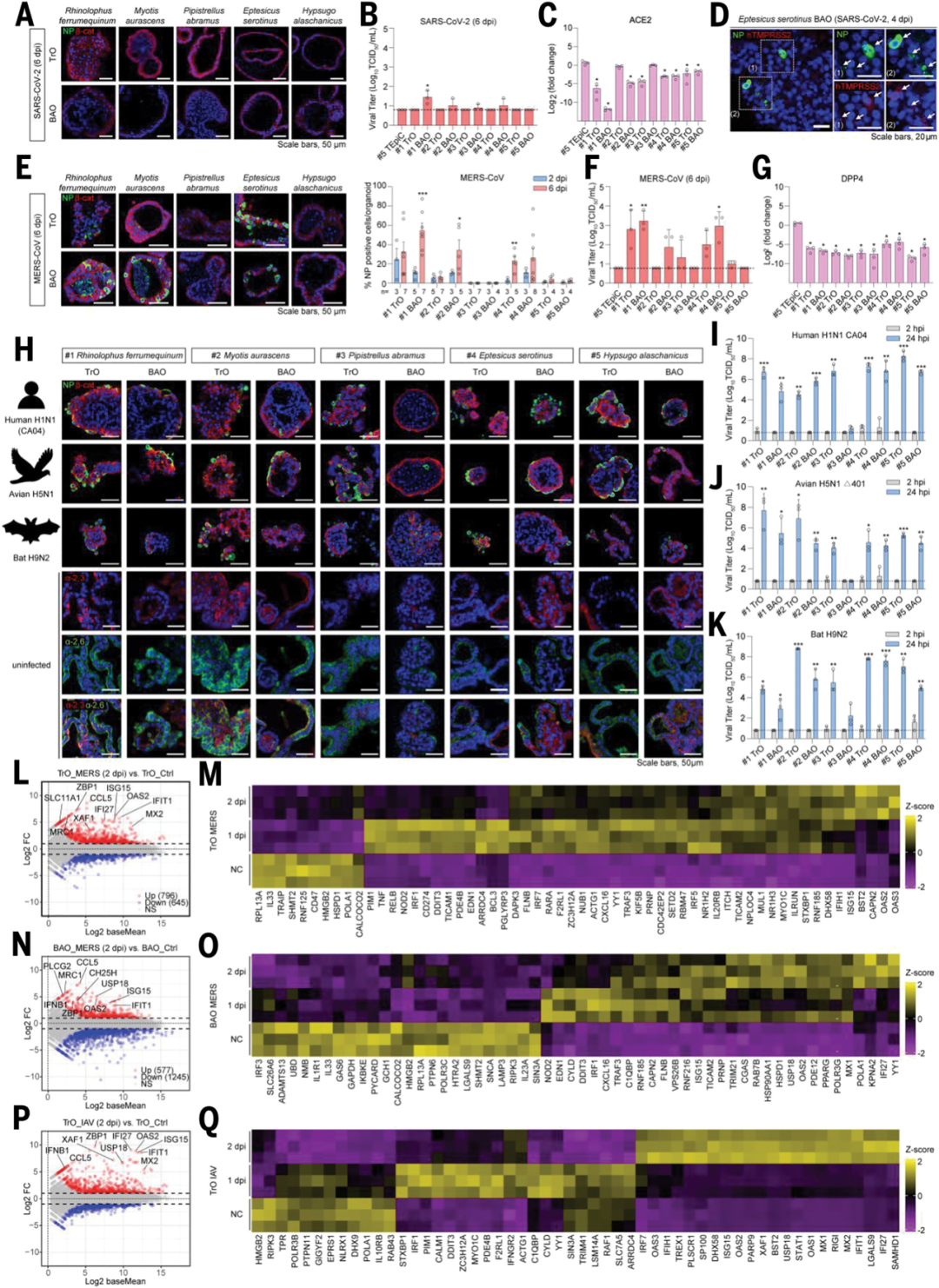
图2:多种蝙蝠呼吸道类器官对人畜共患病毒的感染模型
03 类器官:原代病毒分离平台
通过将蝙蝠粪便及肠内容物样本接种至原代小肠与肾类器官中,研究团队成功分离出两种病毒。其在蝙蝠类器官中能够高效复制,并且能够诱导ISGs的表达。基因组测序和同源性分析显示,分离的病毒与已知蝙蝠病毒存在显著差异,表明其有极大可能是新发现的蝙蝠病毒。
值得注意的是,这些病毒在传统细胞系(如MARC-145)中无法稳定传代,仅能在类器官或初级细胞中维持活性,凸显了类器官平台在病毒分离及培养中的独特价值。
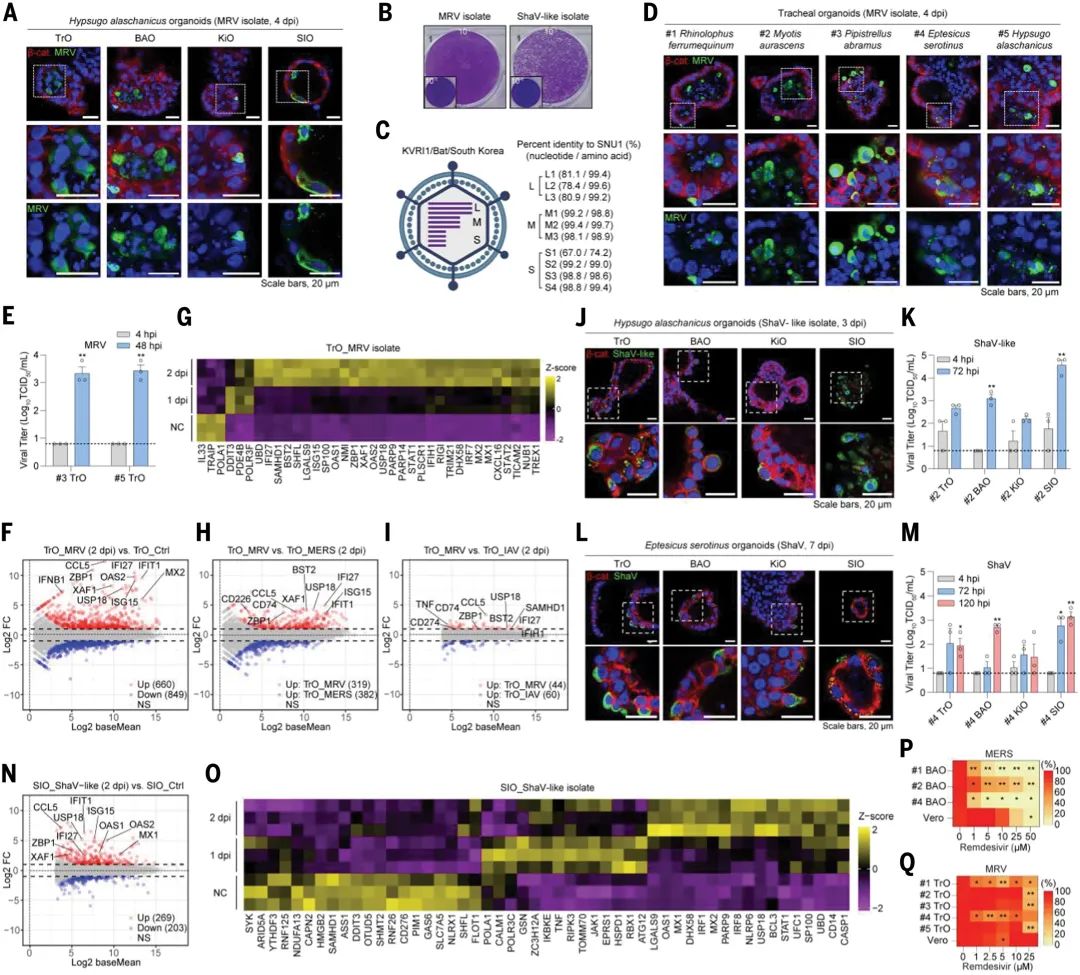
图3:使用多物种和多器官蝙蝠类器官平台分离和表征新型病毒
04 抗病毒筛选平台
最后,为验证类器官作为抗病毒药物筛选平台的潜力,团队将3D类器官转化为Matrigel包被的2D板式系统,在含EGF与Y-27632的诱导培养基中恢复72小时后进行病毒感染,测试确认了瑞德西韦(Remdesivir)等药物抑制MERS-CoV和MRV在蝙蝠类器官中复制的能力。
此外,研究人员还发现,蝙蝠类器官在测试抗病毒药物时表现出比传统细胞系(如Vero E6细胞)更高的敏感性和特异性。
05 总结
该研究首次建立了“多物种-多器官”蝙蝠类器官资源,从而提供了一种低风险、高保真度的新型病毒感染平台。相比传统细胞系,蝙蝠类器官对分离的原代病毒具有更高的培养稳定性,对抗病毒药物表现出更高的敏感性与特异性,因此在病毒溯源、传播机制解析与快速药筛中展示出极高的应用潜力。
不过作者也在结尾指出,该平台仍存在一定局限,如缺乏蝙蝠参考基因组以进行遗传分析,类器官系统中尚未整合免疫细胞,无法完全模拟体内复杂免疫-上皮互作等。未来可进一步拓展血管、神经等组织类器官,并引入免疫细胞共培养体系,构建更完整的蝙蝠微环境模拟系统,以推动类器官平台向“微型生态系统”方向演进。
近岸蛋白相关产品
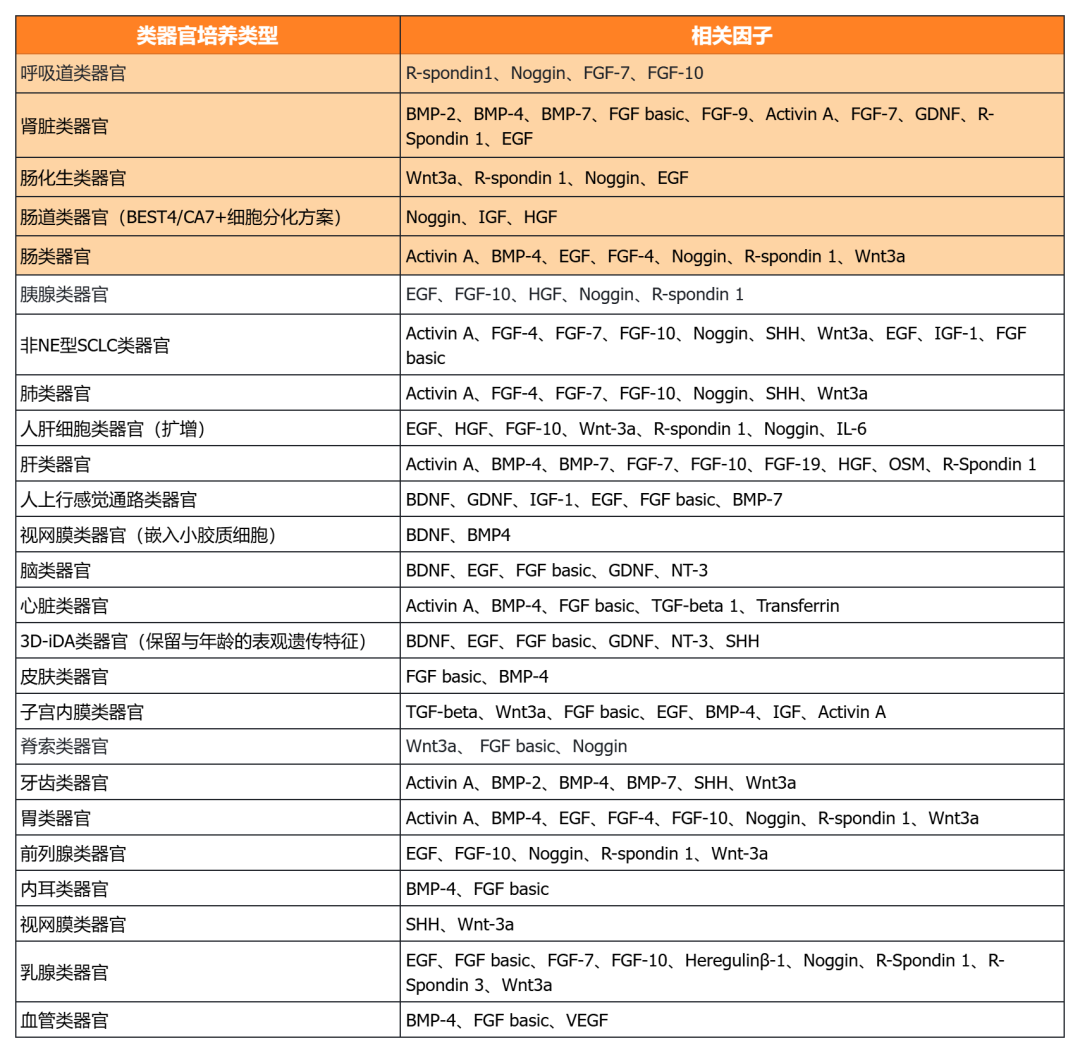
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
经类器官培养验证的细胞因子
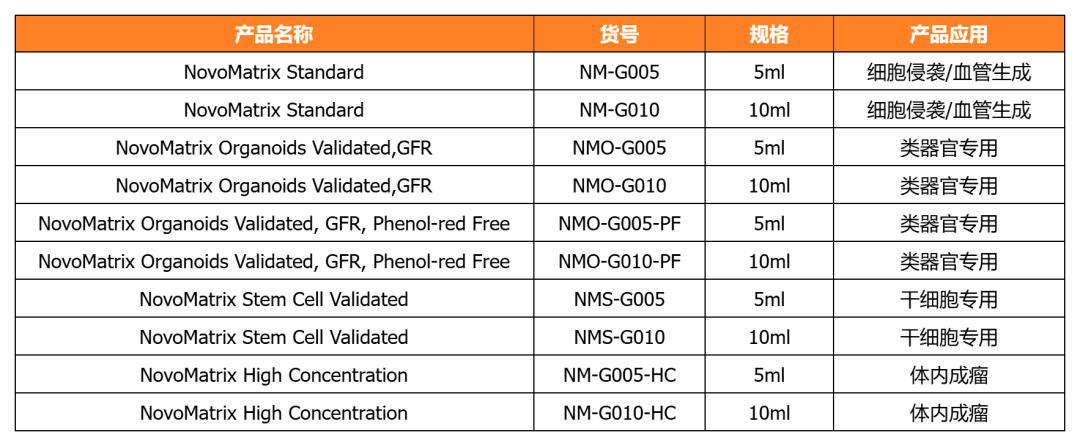
NovoMatrix 基质胶
参考资料
-
Kim, Hyunjoon et al. “Diverse bat organoids provide pathophysiological models for zoonotic viruses.” Science (New York, N.Y.) vol. 388,6748 (2025): 756-762. doi:10.1126/science.adt1438
